1 ml opløsning indeholder 1 mg galsulfase. Præparatet indeholder natrium.
| Navn | Pakkens indhold | Det aktive stof | Pris 100% | Sidst ændret |
| Naglazyme | 1 hætteglas med 5 ml, sidste klargøres løsning til inf. | Galsulfase | 2019-04-05 |
Handling
Et lægemiddel, der påvirker fordøjelseskanalen og stofskifteprodukterne. MPS VI er en heterogen og multisystemforstyrrelse, der er karakteriseret ved en mangel på 4-sulfatase-N-acetylgalactosamin, en lysosomal hydrolase, der katalyserer hydrolysen af de terminale glycosaminoglycansulfatdermatansulfatrester. Nedsat eller manglende enzymaktivitet fører til ophobning af dermatansulfat i mange typer celler og væv. Begrundelsen for terapien er at genoprette enzymatisk aktivitet, der er tilstrækkelig til at hydrolysere det akkumulerede substrat og forhindre yderligere ophobning. Cmax var 2357 (± 1560) ng / ml, gennemsnitlig T0,5 i eliminationsfasen var 22,8 (± 10,7) minutter i uge 24. Galsulfase gennemgår peptidhydrolyse. Nyresekretion af galsulfase bidrager lidt til eliminering af lægemidlet fra kroppen.
Dosering
Det er vigtigt at starte behandlingen så tidligt som muligt, før der opstår irreversible kliniske symptomer på sygdommen. Behandlingen skal være under opsyn af en læge med erfaring i behandling af patienter med MPS VI eller andre nedarvede metaboliske sygdomme. Naglazyme bør administreres i passende kliniske omgivelser med øjeblikkelig adgang til livsstøtteudstyr til behandling af livstruende nødsituationer. Den anbefalede dosis galsulfase er 1 mg / kg kropsvægt. gives en gang om ugen som en intravenøs infusion over 4 timer. Særlige patientgrupper. Ældre: Sikkerheden og effekten af præparatet er ikke fastlagt, og der er ingen anbefalinger til en alternativ doseringsplan. Nyrer og leverforstyrrelser: Sikkerheden og effekten af præparatet er ikke blevet vurderet, og der er ingen anbefalinger til en alternativ doseringsplan for disse patienter. Børn og unge: der er ingen særlige regler, der skal overvejes, når præparatet administreres til denne patientgruppe. Indgivelsesmåde: Den indledende infusionshastighed kan justeres, så ca. 2,5% af den samlede opløsning administreres i løbet af 1 time, og det resterende volumen (ca. 97,5%) administreres i løbet af de næste 3 timer. vejer mindre end 20 kg, overvej brugen af 100 ml infusionsposer. I dette tilfælde bør infusionshastigheden (ml / min) reduceres, så den samlede varighed af infusionen ikke er mindre end 4 timer.
Indikationer
Langvarig enzymerstatning hos patienter med en bekræftet diagnose af mucopolysaccharidosis type VI (MPS VI; N-acetylgalactosamin 4-sulfatase-mangel; Maroteaux-Lamy syndrom). Hovedstøtten i behandlingen er behandlingen af unge patienter <5 år med svær sygdom, skønt patienter <5 år ikke deltog i en central fase 3-undersøgelse. Begrænsede data er tilgængelige for patienter <1 år.
Kontraindikationer
Akut eller livstruende overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne, hvis overfølsomhed ikke kan kontrolleres.
Forholdsregler
Der skal udvises forsigtighed ved behandling og behandling af patienter med restriktiv lungesygdom eller omhyggelig overvågning af brugen af antihistaminer og andre beroligende midler. Brug af positivt luftvejstryk under søvn og muligheden for en trakeostomi, når det er klinisk passende, bør overvejes. Infusionen af lægemidlet kan være nødvendigt at udskyde hos patienter med akut febersygdom eller med åndedrætsbesvær. På grund af den mulige forekomst af infusionsassocierede reaktioner (IAR'er), som forstås at betyde eventuelle bivirkninger, der forekommer under infusionen eller inden slutningen af infusionsdagen, anbefales det, at patienter præmedicineres med antihistaminer i kombination med antipyretika. eller uden dem, ca. 30-60 min. inden infusion af præparatet påbegyndes for at reducere risikoen for IAR-symptomer. Ved milde til moderate symptomer på en IAR skal du overveje behandling med antihistaminer og paracetamol og / eller reducere infusionshastigheden til mindre end halvdelen af responshastigheden. I tilfælde af enkelte alvorlige symptomer på IAR bør infusionen stoppes, indtil symptomerne forsvinder, og behandling med antihistaminer og paracetamol bør overvejes. Infusionen kan genstartes med 50% -25% af den hastighed, hvormed den reagerede. Ved tilbagevendende moderate IAR-symptomer eller genbehandling efter enkelt alvorlige IAR-symptomer, skal man overveje præmedicinering (med antihistaminer og paracetamol og / eller kortikosteroider) og reducere infusionshastigheden til 50% -25% af den hastighed, hvormed det foregående respons opstod. Alvorlige allergiske overfølsomhedsreaktioner er mulige, hvis de opstår, anbefales det straks at afbryde præparatet og gennemføre passende behandling. De gældende regler for håndtering af en nødsituation skal overholdes. Patienter, der har oplevet en allergisk reaktion under infusionen af lægemidlet, bør genprøves med særlig forsigtighed; Specielt uddannet medicinsk personale og tilgængeligt genoplivningsudstyr (inklusive adrenalin) skal være til stede under administration. Akut eller potentielt livstruende overfølsomhed, der ikke kan kontrolleres, er en kontraindikation til gendosering. Præparatet indeholder natrium - der skal udvises forsigtighed hos patienter i en diæt med et begrænset natriumindhold. Rygmarvskompression, også i livmoderhalsområdet, med efterfølgende myelopati er en kendt og alvorlig komplikation, der kan være forårsaget af MPS VI - patienter skal overvåges for tegn og symptomer på rygmarvskompression (rygsmerter, lammelse under trykpunktet, inkontinens urin og afføring) og om nødvendigt få passende pleje.
Uønsket aktivitet
Meget almindelig: faryngitis, gastroenteritis, areflexia, hovedpine, konjunktivitis, hornhindeopacitet, ørepine, nedsat hørelse, hypertension, dyspnø, næsestop, mavesmerter, navlebrok, opkastning, kvalme, ansigtsødem, udslæt , nældefeber, kløe, smerter, brystsmerter, kulderystelser, utilpashed, feber, ledsmerter. Almindelig: kramper, hypotension, apnø, hoste, åndedrætssvigt, astma, bronkospasmer, erytem. Ikke kendt: anafylaktisk reaktion, chok, paræstesi, bradykardi, takykardi, cyanose, bleghed, larynxødem, hypoxi, hurtig vejrtrækning.
Graviditet og amning
Lægemidlet må ikke bruges under graviditet, medmindre det er klart nødvendigt. Amning skal stoppes under behandlingen med præparatet. Reproduktive undersøgelser udført på rotter og kaniner, der fik lægemidlet i doser op til 3 mg / kg / dag, viste ingen tegn på nedsat fertilitet eller skadelige virkninger på fosteret forårsaget af lægemidlet.
Præparatet indeholder stoffet: Galsulfase
Refunderet stof: NEJ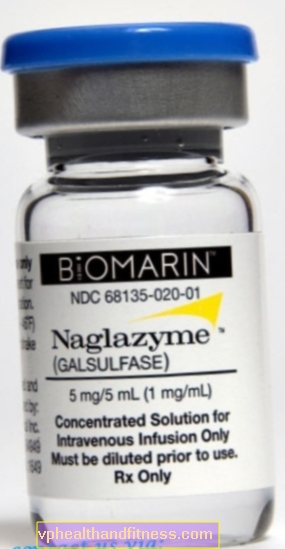














.jpg)