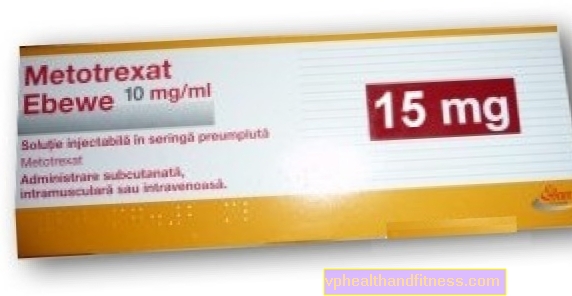
1 ml opløsning indeholder 20 mg methotrexat (som dinatriumsalt).
| Navn | Pakkens indhold | Det aktive stof | Pris 100% | Sidst ændret |
| Ebetrexat | 4 ampere sprøjte. 1,5 ml, sol. for chok | Methotrexat | PLN 358.1 | 2019-04-05 |
Handling
En cytostatikum fra gruppen af antimetabolitter, folsyreantagonist. Methotrexat virker ved konkurrerende inhibering af dihydrofolatreduktase og inhiberer følgelig DNA-syntese. Det er også immunsuppressivt. Efter subkutan, intramuskulær og intravenøs administration er biotilgængeligheden af methotrexat ens. Ca. 50% af methotrexat er bundet til plasmaproteiner. I fordelingsfasen akkumuleres det hovedsageligt i leveren, nyrerne og milten i form af polyglutamater, som forbliver i disse organer i flere uger eller måneder. Når det administreres i små doser, trænger det ind i kropsvæsker i minimale mængder. Ca. 10% af det metaboliseres i leveren, hovedmetabolitten er 7-hydroxymethotrexat. Det udskilles af nyrerne, hovedsageligt uændret. Ca. 5-20% methotrexat og 1-5% 7-hydroxymethotrexat udskilles i galden. Methotrexat er til stede i betydelige mængder i den enterohepatiske cirkulation. Den gennemsnitlige terminal T0.5 er 6-7 timer og viser betydelig variation (3-17 timer); T0.5 er forlænget hos patienter med nedsat nyrefunktion såvel som hos patienter med pleural effusion eller ascites.
Dosering
Reumatoid arthritis (voksne). Administrer subkutant, intramuskulært eller intravenøst (bolus). Den anbefalede startdosis er 7,5 mg en gang om ugen, afhængigt af sygdommens individuelle sværhedsgrad og lægemiddeltolerance, kan den indledende dosis øges. Som hovedregel må du ikke bruge mere end 25 mg / uge. Et respons på behandlingen kan forventes efter ca. 4-8 uger. Efter at den ønskede effekt er opnået, skal dosis gradvist reduceres til den lavest mulige effektive vedligeholdelsesdosis. Polyartikulære former for juvenil idiopatisk arthritis (børn og unge). Subkutant eller intramuskulært. Den anbefalede dosis er 10-15 mg / m2 / uge. I ildfaste tilfælde kan den ugentlige dosis øges til 20 mg / m2 / uge. Ikke anbefalet til børn i alderen Alvorlige former for psoriasis og psoriasisgigt (voksne) Gives subkutant, intramuskulært eller intravenøst (bolus) Det anbefales, at der gives en testdosis på 5 til 10 parenteralt methotrexat en uge inden behandlingsstart. mg til vurdering af idiosynkratiske bivirkninger Den anbefalede startdosis er 7,5 mg en gang om ugen. Dosis bør øges gradvist. Generelt bør doser ikke overstige 25 mg / uge. I undtagelsestilfælde kan en højere dosis være klinisk berettiget, men den maksimale dosis på 30 mg / uge bør ikke overskrides Svar på behandling kan forventes efter ca. 2-6 uger. dosis bør gradvist reduceres til den lavest mulige effektive vedligeholdelsesdosis. Særlige patientgrupper. Patienter med nedsat nyrefunktion: kreatininclearance (CCr)> 50 ml / min: brug 100% af den krævede dosis; CCr 20-50 ml / min: brug 50% af den krævede dosis; CCr på 0,5 methotrexat kan forlænges op til 4 gange, derfor kan det i nogle tilfælde være nødvendigt at reducere dosis eller afbryde methotrexat.
Indikationer
Aktiv reumatoid arthritis hos voksne patienter. Polyartikulære former for alvorligt aktiv juvenil idiopatisk arthritis, når behandling med ikke-steroide antiinflammatoriske lægemidler (NSAID'er) har mislykkedes. Alvorlig, ildfast, deaktiverende psoriasis hos voksne patienter, der ikke har reageret tilstrækkeligt på andre behandlinger såsom fototerapi, fotokemoterapi (PUVA) og retinoider og svær psoriasis i leddene (psoriasisgigt).
Kontraindikationer
Overfølsomhed over for methotrexat eller over for et eller flere af hjælpestofferne. Alvorlig nedsat leverfunktion - serum bilirubin> 5 mg / dl (85,5 µmol / l). Alkohol misbrug. Alvorlig nedsat nyrefunktion - kreatininclearance 2 mg / dl. Historie af hæmatologiske sygdomme, såsom knoglemarvshypoplasi, leukopeni, trombocytopeni eller klinisk signifikant anæmi. Immunmangel. Alvorlige, akutte eller kroniske infektioner såsom tuberkulose og HIV-infektion. Betændelse og / eller sårdannelse i mundslimhinden. Kendt aktiv peptisk mavesårsygdom i mave og / eller tolvfingertarm. Samtidig vaccination med levende vacciner. Graviditet og amning.
Forholdsregler
Methotrexat bør kun indgives af eller under tilsyn af læger med viden og erfaring i brugen af antimetabolit-cytotoksiske lægemidler. Under behandling med methotrexat er regelmæssig overvågning af patientens tilstand nødvendig med korte intervaller for at opdage tegn på lægemiddeltoksicitet og vurdere dem så hurtigt som muligt. Før behandling med methotrexat påbegyndes eller behandlingen genoptages efter en afbrydelse, skal der udføres en komplet blodtælling med udtværings- og blodpladetal, leverenzymer, serum bilirubin og albumin, røntgenstråler og brystfunktionstest skal udføres, og graviditet bør udelukkes; hvis klinisk indiceret, ekskluder tuberkulose og hepatitis. Under behandlingen - ugentligt i de første 2 ugers behandling, derefter hver anden uge i den næste måned, derefter mindst en gang om måneden i de næste 6 måneders behandling og derefter mindst en gang hver 3. måned, skal følgende tests udføres: undersøgelse af mund og hals for slimhindelæsioner, komplet blodtal med udstrygning og blodpladetal, leverfunktionstest, nyrefunktionstest (inklusive urinanalyse), test for mulig lungedysfunktion og om nødvendigt blodfunktionstest spytte. Hyppigere kontrol bør overvejes hos ældre og når dosis øges. Ethvert signifikant fald i antallet af leukocytter eller blodplader kræver øjeblikkelig seponering af behandlingen og implementeringen af passende understøttende behandling. Patienter bør rådes til at rapportere alle symptomer, der tyder på at udvikle infektion. Særlig overvågning af blodtal og blodpladetælling kræver patienter, der behandles samtidigt med andre lægemidler, der er giftige for det hæmatopoietiske system (f.eks. Leflunomid). Knoglemarvsbiopsi skal udføres under langvarig behandling med methotrexat. Der skal lægges særlig vægt på tidlige tegn på hepatotoksicitet. Behandlingen bør ikke påbegyndes eller skal stoppes med det samme, hvis der observeres abnormiteter i leverfunktionstest eller abnormiteter med biopsimateriale før eller under behandling med methotrexat (disse skal løses inden for 2 uger; på hvilket tidspunkt genoptagelse af behandlingen kan overvejes). Der er ingen beviser for, at en leverbiopsi er nyttig til overvågning af hepatotoksicitet ved behandling af reumatiske sygdomme. Hos patienter med psoriasis er behovet for leverbiopsi før og under behandlingen kontroversielt. Yderligere undersøgelser er nødvendige for at bestemme, om gentagne leverprøver eller test af kollagenpropeptid af type III er tilstrækkelig effektive til at bestemme levertoksicitet. Individuel patientvurdering bør udføres under hensyntagen til forskelle i tilstedeværelse eller fravær af risikofaktorer, såsom: tidligere overdreven alkoholforbrug, vedvarende forhøjelse af leverenzymer, historie med leversygdom, familiehistorie af arvelige leversygdomme, diabetes, fedme, tidligere eksponering for Hepatotoksiske lægemidler eller stoffer og langvarig behandling med methotrexat eller anvendelse af kumulative doser på ≥ 1,5 g. Hvis leverenzymer forbliver høje, skal du overveje at reducere dosen af methotrexat eller stoppe behandlingen. Under behandling med methotrexat bør andre hepatotoksiske lægemidler ikke anvendes, medmindre det er absolut nødvendigt (i dette tilfælde bør alkoholforbruget afbrydes eller reduceres signifikant, og leverenzymernes aktivitet bør overvåges nøje); dette gælder også samtidig brug af lægemidler med en toksisk virkning på det hæmatopoietiske system. Dosen af methotrexat bør reduceres, hvis der opstår nyrefunktion. Mistænkt nyrefunktion (f.eks. Hos ældre patienter) kræver hyppigere test, især når andre lægemidler anvendes sammen med methotrexat, der påvirker dets udskillelse, forårsager nyreskade (f.eks. NSAID'er) eller kan være skadelige for det hæmatopoietiske system . I nærvær af risikofaktorer såsom nedsat nyrefunktion (endda borderline) anbefales ikke samtidig brug af NSAID'er. Patienterne bør rådes til at rapportere om generende åndedrætssymptomer, såsom vedvarende hoste eller dyspnø. Hos patienter med lungesymptomer bør methotrexat seponeres og en grundig undersøgelse (inklusive røntgenfoto af brystet) for at udelukke infektion og tumorer. Hvis det mistænkes for, at symptomerne på lungesygdomme er relateret til virkningerne af methotrexat, bør behandling med kortikosteroider påbegyndes, og behandling med methotrexat må ikke genstartes. Hos patienter med lungesymptomer bør diagnosen opportunistiske infektioner, herunder pneumocystose, også overvejes. Der skal udvises særlig forsigtighed: hos patienter med nedsat lungefunktion; i tilfælde af latente, kroniske infektioner (f.eks helvedesild, tuberkulose, hepatitis B eller C) på grund af muligheden for at forværre sygdommen hos patienter med patologisk væskeophobning i kropshulrum (f.eks. med ascites eller pleural effusion) på grund af langvarig eliminering af methotrexat (i tilfælde af pleural og peritoneal effusion skal dræning udføres inden behandling med methotrexat påbegyndes). Tilstande, der fører til dehydrering, såsom opkastning, diarré og stomatitis kan øge koncentrationen og toksiciteten af methotrexat; I sådanne tilfælde bør behandlingen med methotrexat seponeres, indtil symptomerne forsvinder. Diarré og ulcerøs stomatitis kan være tegn på methotrexats toksicitet og kræve seponering af behandlingen. Behandlingen bør afbrydes, hvis der opstår blodig opkastning, sort afføring eller blod i afføringen.Maligne lymfomer kan udvikle sig hos patienter, der får lave doser methotrexat; i dette tilfælde skal behandlingen stoppes; hvis lymfom ikke viser tegn på spontan regression, er behandling med cytotoksiske lægemidler nødvendig. Den strålingsinducerede dermatitis og solskoldningsinduceret dermatitis (kaldet en "påmindelsesreaktion") kan komme tilbage med methotrexat. Hudlæsionerne ved psoriasis kan forværres under bestråling med UV-lys og samtidig administration af methotrexat. Methotrexat kan reducere responsen på vaccination og kan interferere med resultaterne af immunologiske tests. Under behandlingen kan tilskud med folinsyre eller folinsyre overvejes i overensstemmelse med gældende behandlingsretningslinjer. Det skal huskes, at vitaminer eller andre præparater, der indeholder folinsyre, folinsyre eller derivater deraf, kan reducere effektiviteten af methotrexat. Undgå kontakt med methotrexat med huden og slimhinderne. Brug af methotrexat til børn <3 år anbefales ikke.
Uønsket aktivitet
Forekomsten og intensiteten af de uønskede virkninger afhænger af dosis af lægemidlet og hyppigheden af indgivelse, men alvorlige bivirkninger kan forekomme selv ved lave doser methotrexat. Meget almindelig: appetitløshed, kvalme, opkastning, mavesmerter, betændelse og sårdannelse i oropharyngeal slimhinde (især i de første 24-48 timer efter administration), stigning i leverenzymer (ALAT, AST, alkalisk phosphatase) og bilirubinniveauer. Almindelig: leukopeni, trombocytopeni, anæmi, hovedpine, træthed, søvnighed, paræstesi, lungekomplikationer på grund af interstitiel alveolitis eller lungeeffusion og død relateret til disse komplikationer (uanset dosis og behandlingsvarighed med methotrexat; de mest almindelige symptomer er : generel utilpashed, tør, irriterende hoste, åndenød, der omdannes til dyspnø i hvile, brystsmerter, feber), diarré (især i de første 24-48 timer efter administration), udslæt, erytem, kløe. Ikke almindelig: herpes zoster, malignt lymfom, pancytopeni, agranulocytose, hæmatopoietiske lidelser, allergiske reaktioner, anafylaktisk shock, diabetes mellitus, depression, hemiplegi, svimmelhed, forvirring, krampeanfald, leukoencefalopati / encefalopati (efter parenteral administration) , lungefibrose, pleural effusion, gastrointestinal ulceration og blødning, pancreatitis, udvikling af steatose, leverfibrose og cirrose (forekommer ofte på trods af regelmæssig monitorering og normale leverenzymer), nedsat serumalbumin, urticaria, lysfølsomhed, øget hudpigmentering, hårtab, lidelser i sårheling, forstørrelse af reumatiske knuder, ømhed af psoriasislæsioner (psoriasislæsioner kan forværres af UV-stråling under behandling med methotrexat), herpeslignende udbrud på huden, Stevens-Johnson syndrom, giftig epidermal nekrolyse, ledsmerter, muskelsmerter, osteoporose, betændelse og sårdannelse i blæreslimhinden (kan omfatte hæmaturi), smertefuld vandladning, betændelse og sårdannelse i vaginal slimhinde, reaktioner på injektionsstedet - efter intramuskulær injektion (brændende fornemmelse) eller vævsskade, dannelse af en steril byld, tab af fedtvæv). Sjælden: sepsis, megaloblastisk anæmi, humørsvingninger, kortvarige ændringer i opfattelsen, lammelse, taleforstyrrelser (inklusive dysartri og afasi), alvorlige synsforstyrrelser, svær dystopi af ukendt oprindelse, hypotension, tromboemboliske hændelser (inklusive arteriel og vaskulær trombose) hjerne, tromboflebitis, dyb venetrombose, retinal vaskulær trombose, lungeemboli), faryngitis, apnø, enteritis, tarry afføring, tandkødsbetændelse, akut hepatitis og hepatotoksicitet, forværring af neglepigmenteringsændringer, frigørelse af neglepladen , acne, ecchymosis, blødning, erythema multiforme, erytematøs hududslæt, brud på grund af overbelastning, azotæmi, abort, oligospermi, menstruationsforstyrrelser. Meget sjælden: infektion med herpes simplex-virus, hepatitis, svær myelosuppression, aplastisk anæmi, hypogammaglobulinæmi, smerter, muskelsvaghed i lemmer, dysgeusi (metallisk smag), akut aseptisk meningitis med meningitis (lammelse, opkastning), konjunktivitis, perikarditis, perikardial effusion, perikardial tamponade, Pneumocystis carinii lungebetændelse, kronisk obstruktiv lungesygdom, bronkialastma, hæmatemese, akut levernekrose, akut paronychia, furunkulose, telangiectasia, proteinuria, fosterdød, spermatogenese , tab af sexlyst, impotens, vaginal udflåd, infertilitet, feber. Ikke kendt: opportunistiske infektioner (kan være fatale i nogle tilfælde), fatal sepsis, histoplasmose og kryptokokose, nocardiose, dissemineret herpes simplex-virusinfektion, cytomegalovirusinfektioner inklusive lungebetændelse, hepatitis B-reaktivering, forværring af hepatitis type C, lymfadenopati, lymfoproliferative sygdomme (delvis reversible), eosinofili og neutropeni, immunsuppression, feber, allergisk vaskulitis, buløs blødning, ikke-infektiøs peritonitis, leversvigt, sårhelingsforstyrrelser. De bivirkninger, der normalt observeres ved højere doser methotrexat ved onkologiske indikationer, inkluderer: ikke almindelig: svær nefropati, nyresvigt; meget sjælden: unormale kraniet fornemmelser, midlertidigt synstab.
Graviditet og amning
Methotrexat er teratogent, forårsager fosterskader og / eller abort. Brug af methotrexat under graviditet er kontraindiceret. Inden behandlingen påbegyndes, bør graviditet udelukkes ved hjælp af pålidelige metoder, f.eks. En graviditetstest. Patienter (kvinder og mænd) skal bruge effektiv prævention under og op til 6 måneder efter ophør af behandling med methotrexat. Da methotrexat kan være genotoksisk, bør genetisk rådgivning være tilgængelig for alle kvinder, der planlægger graviditet, inden behandlingen påbegyndes. Mænd bør søge rådgivning om sædopbevaring inden behandling. Methotrexat overgår i modermælken og kan skade det ammede barn, derfor er dets anvendelse under amning kontraindiceret.
Kommentarer
1 dosis af lægemidlet indeholder
Interaktioner
NSAID'er, herunder salicylsyre, reducerer den tubulære sekretion af methotrexat og øger dets toksicitet; NSAID'er kan anvendes under behandlingen af reumatoid arthritis med lave doser methotrexat, men kun under streng medicinsk overvågning. Den hepatotoksiske virkning af methotrexat forstærkes af andre lægemidler, der potentielt er skadelige for leveren og det hæmatopoietiske system (dvs. leflunomid, azathioprin, sulfasalazin og retinoider) og regelmæssigt alkoholforbrug. Alkohol bør undgås under behandling med methotrexat. Hæmatotoksicitet af methotrexat forværres af lægemidler med en toksisk virkning på det hæmatopoietiske system (f.eks. Metamizol). Kombinationsbehandling med methotrexat og leflunomid kan øge risikoen for pancytopeni. Methotrexat øger mercaptopurins blodniveauer, hvorfor kombinationsbehandling muligvis kræver dosisjustering af hvert af disse lægemidler. Antikonvulsiva reducerer mængden af methotrexat i blodet. Methotrexat øger T0,5 for 5-fluorouracil. Salicylater, phenylbutazon, phenytoin, barbiturater, beroligende midler, orale svangerskabsforebyggende midler, tetracycliner, aminophenazonderivater, sulfonamider og p-aminobenzoesyre fortrænger methotrexat fra plasmaproteinbindingssteder og øger dets biotilgængelighed (indirekte dosisforøgelse). Probenecid og svage organiske syrer kan reducere den tubulære sekretion af methotrexat, hvilket også indirekte øger dosis. Penicilliner, glycopeptider, sulfonamider, ciprofloxacin og cephalotin kan nedsætte den renale clearance af methotrexat, øge blodkoncentrationen og intensivere dets toksicitet. Orale antibiotika, såsom tetracycliner, chloramphenicol og bredspektrede, ikke-absorberbare antibiotika, kan begrænse tarmabsorptionen af methotrexat eller forringe enterohepatisk cirkulation ved at ødelægge tarmfloraen eller hæmme den metaboliske aktivitet af bakterier. Sulfonamider, trimethoprim med sulfamethoxazol, chloramphenicol, pyrimethamin kan øge methotrexats myelotoksicitet. Lægemidler, der forårsager folatmangel, f.eks. Sulfonamider, trimethoprim med sulfamethoxazol, kan øge de toksiske virkninger af methotrexat (der skal udvises særlig forsigtighed hos patienter med folatmangel). På den anden side kan lægemidler, der indeholder folinsyre eller vitaminpræparater med folinsyre eller dets derivater, reducere effektiviteten af methotrexat. Samtidig brug af methotrexat og andre antireumatiske lægemidler, fx guldsalt, penicillamin, hydroxychloroquin, sulfasalazin, azathioprin, cyclosporin, øger generelt ikke toksiciteten af methotrexat. Kombinationsterapi med methotrexat og sulfasalazin kan øge effekten af methotrexat ved at hæmme sulfasalazin-induceret folinsyresyntese og dermed øge risikoen for toksiske effekter, men dette er kun observeret hos enkelte patienter i nogle få kliniske forsøg. Samtidig administration af methotrexat og omeprazol forsinker renal eliminering af methotrexat. I et tilfælde resulterede den samtidige anvendelse af methotrexat og pantoprazol i hæmning af renal udskillelse af 7-hydroxymethotrexat (en af metabolitterne af methotrexat) ledsaget af myalgi og kulderystelser. Methotrexat kan reducere clearance af teophyllin - blodniveauer af theophyllin bør overvåges under denne kombinationsbehandling. Undgå overdreven indtagelse af koffeinholdige eller theophyllinholdige drikkevarer (kaffe, koffeinholdige drikkevarer, sort te) under behandling med methotrexat, da methotrexats effektivitet kan reduceres på grund af en mulig interaktion mellem methotrexat og methylxanthiner på adenosinreceptorniveauet. Methotrexat bør anvendes med forsigtighed med immunmodulatoriske lægemidler, især i ortopædkirurgi, når risikoen for infektion er høj. På grund af dets mulige virkninger på immunsystemet kan methotrexat reducere effektiviteten af vaccination og forårsage falske resultater af test til vurdering af immunresponset (immunologiske procedurer, der registrerer et immunrespons). Levende vacciner er kontraindiceret under behandling med methotrexat. Strålebehandling under behandling med methotrexat kan øge risikoen for blødt væv eller knoglenekrose. Udskillelsen af methotrexat kan være forsinket, når det kombineres med andre cytostatika. Colestyramin kan forbedre den ikke-renale eliminering af methotrexat ved at forstyrre levercirkulationen. Nitrogenoxidanæstetika øger effekten af methotrexat på folinsyreomsætningen og forårsager alvorlig, uforudsigelig undertrykkelse af knoglemarv og betændelse i mundslimhinden; denne effekt kan reduceres ved administration af calciumfolinat.
Pris
Ebetrexat, pris 100% 358 PLN
Præparatet indeholder stoffet: Methotrexat
Refunderet lægemiddel: JA