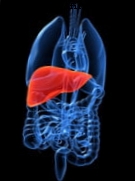
Tirsdag den 22. april 2014.- Forestil dig, at læger kunne åbne frysere og vælge nyrer, lever eller hjerter til brug i livreddende operationer. Følgende forklarer, hvorfor dette er så svært at opnå.
Hvis du har brug for en ny nyre, et erstatningshjerte eller et andet vigtigt organ, har du ikke mange muligheder. Dette skyldes, at når det kommer til sunde menneskelige organer til transplantationer, der kan redde liv, er der et enormt kløft mellem udbud og efterspørgsel.
I USA blev 26.517 organer transplanteret i 2013, men mere end 120.000 patienter er på ventelisten. Kort sagt, der er ikke nok donationer til alle.
Endnu værre er det, at de organer, der er tilgængelige, spilder nogle gange, fordi de ikke har meget holdbarhed, når den først er fjernet fra donoren.
I øjeblikket er det bedste, vi kan gøre, at holde dem i en speciel løsning lige over 0 grader celsius i en eller to dage, hvilket ikke giver meget tid til at finde patienter, der er fuldt kompatible modtagere til at modtage dem.
Men der er et muligt svar. Hvis forskere kunne finde en måde at fryse organer og bringe dem tilbage uden at pådrage sig skade, kunne vi muligvis opbevare dem i uger eller måneder.
Det samme kunne gøres med de organer, der er designet i laboratoriet, hvis vi er i stand til at skabe dem. Med dette i tankerne planlægger kliket Organ Preservation Alliance, en velgørenhed knyttet til laboratorierne ved Singularity University i NASA Research Park i Californien, at skabe en millionærpris for dem, der tilskynder til fremskridt i denne forbindelse.
Så kunne vi se et tidspunkt, hvor transplantationskirurger åbner frysere og vælger nyrer, lever eller hjerter for at udføre livreddende operationer?
Forskere har kryopervarer eller fryset små grupper af menneskelige celler i 40 år.
De sparer ægløsning og embryoner, der oversvømmer cellerne med opløsninger af de såkaldte kryobeskyttelsesforbindelser, som forhindrer dannelse af iskrystaller, der kan ødelægge cellerne og også beskytte dem mod dødbringende sammentrækning.
Desværre støder de på store forhindringer, når de prøver at implementere denne proces i større skala, da arkitekturen inden for de mest komplekse organer og væv er meget mere sårbar overfor skader relateret til iskrystaller.
En lille gruppe forskere har imidlertid ikke givet op og forbereder sig til udfordringen delvist efter naturens spor.
For eksempel overlever isfisk i Antarktis i meget koldt vand ved -2 grader celsius takket være frostvæskeproteiner (AFP), som reducerer frysepunktet for deres kropsvæsker og binder til Iskrystaller for at stoppe dens spredning.
Forskere har brugt opløsninger, der indeholder antarktiske isfisk-AFP'er til at bevare rottehjerter i en periode på op til 24 timer på nogle få grader under nul.
Imidlertid forekommer modproduktive virkninger ved AFP'erne for dette dyr ved en lavere temperatur: de tvinger dannelsen af iskrystaller til at producere skarpe punkter, der gennemborer cellemembranerne.
En anden frostvæskeforbindelse, der for nylig blev opdaget i en Alaskan-bille, der tåler -60 ° C, kan være mere nyttig.
Men frostvæskeingredienserne alene vil ikke gøre jobbet. Dette skyldes, at frysning også ødelægger celler ved at påvirke strømmen af væsker ind og ud af dem.
Der dannes is i mellemrummet mellem celler, hvilket reducerer væskemængden og øger koncentrationen af opløste salte og andre ioner. Vand løber fra cellerne udad for at kompensere, hvilket får dem til at visne og dø.
I ægløsning og embryoner er kryobeskyttende forbindelser som glycerol meget nyttige: de fortrænger ikke kun vand for at forhindre dannelse af is i cellerne, men hjælper også med at forhindre cellekontraktion og død.
Problemet er, at disse forbindelser ikke kan arbejde med den samme magi i organerne. På den ene side er vævsceller meget mere modtagelige for isindtrængning.
Og selv når cellerne er beskyttet, ødelægger de iskrystaller, der dannes i mellemrummet mellem dem, de ekstracellulære strukturer, der holder organet sammen og letter dets funktion.
En måde at overvinde farerne ved isdannelse er at forhindre, at det sker. Derfor er nogle forskere forpligtet til en teknik kaldet forglasning, hvor vævene bliver så kolde, at de bliver et isfrit glas.
Metoden er allerede anvendt af nogle fertilitetsklinikker og har produceret nogle af de hidtil mest opmuntrende resultater med hensyn til konservering af komplekse væv.
I 2000 forglasede for eksempel Mike Taylor og hans kolleger ved Cell and Tissue Systems i Charleston, South Carolina, 5 cm lange segmenter af en kanins vene, som er placeret mellem celler og organer med hensyn til kompleksitet og viste, at de bevarer det meste af deres funktion efter opvarmning.
To år senere lavede Greg Fahy og hans kolleger ved det 21. århundrede Medicine, et Californien-baseret cryopreservation forskningsfirma, et gennembrud: De forglasede en kanins nyre og holdt den under glasovergangstemperaturen på - 122 grader celsius i 10 minutter, før de blev afrimet og transplanteret til en kanin, der levede i 48 dage, før den blev slagtet for at undersøge den.
"Det var første gang, at et vitalt organ med efterfølgende livsstøtte var blevet kryopervarer og transplanteret, " siger Fahy. "Det var et bevis på, at det var et realistisk forslag."
Men nyrerne virkede ikke så godt som en sund version, hovedsageligt fordi en bestemt del, medulla, tog længere tid at absorbere kryoprotektantopløsningen, hvilket betød, at der dannedes noget is på den under afrimning.
”Selvom vi var i store humør, vidste vi også, at vi måtte forbedre os, ” tilføjer Fahy.
"Det er det tætteste, vi er kommet, " siger Taylor og tilføjer en advarsel. "Det var mere end 10 år siden, og hvis teknikken var robust nok, skulle der have været rapporter og opfølgningsundersøgelser, der vidner om fundet, noget der ikke har eksisteret."
Fremskridt har til dels været langsom, siger Fahy, fordi det ophørte med at fremstille et kemikalie, der var en nøgledel af hans metode. Imidlertid er hans gruppe genvundet og trådt frem: på det årlige møde i Cryobiology Society i 2013 præsenterede Fahy en metode, der giver ledningen mulighed for at indlæse hurtigere med kryobeskyttelsesmidler.
På trods af Fahys optimisme er det klart, at når det drejer sig om at bevare store organer, udgør forglasning nogle formidable udfordringer. Til at begynde med er der behov for høje koncentrationer af kryobeskyttelsesmidler (mindst fem gange større end ved konventionel langsom afkøling), som kan forgifte celler og væv, de skal beskytte.
Problemet forværres med større væv, fordi der kræves mere tid til at indlæse forbindelserne, hvilket betyder langsommere afkølingstider og flere muligheder for giftig eksponering. Hvis køling derudover er for hurtig eller når for lave temperaturer, kan der muligvis opstå revner.
Denne ekstremt delikate opvarmningsproces giver flere hindringer. Hvis det forglasede præparat ikke opvarmes hurtigt eller forholdsvis ensartet, giver glasigheden plads til krystallisation, en proces, der kaldes devitrifikation, og igen, kan der opstå revner.
(Dette) er en udfordring, som vi endnu ikke har overvundet, "siger John Bischof, kryobiolog og ingeniør ved University of Minnesota." Den begrænsende faktor er den hastighed og ensartethed, som vi kan afrime det. "Og det er fordi Opvarmning udføres normalt udefra og indefra.
Sidste år foreslog Bischof og kandidatstuderende Michael Etheridge en måde at løse problemet på: tilføj magnetiske nanopartikler til kryobeskyttelsesløsningen.
Tanken er, at partiklerne spreder sig gennem vævet og, når de først er begejstrede for magnetfelterne, opvarmer alt hurtigt og jævnt. Duoen arbejder i øjeblikket med Taylor og hans kolleger for at teste metoden i arterier af kaniner.
For det meste er fremskridt på området sket ved forsøg og fejl: test af kombinationer af løsninger og metoder til frysning og optøning.
Men forskere er også begyndt at drage fordel af nye teknologier for at undersøge nærmere, hvordan is opfører sig i celler og væv.
Hvis processerne forstås detaljeret, kan det forventes, at innovative og mere effektive metoder kan designes til at kontrollere dem.
I de sidste 12 måneder er der sket betydelige fremskridt på dette område. Taylor, der arbejder med Yoed Rabin, en maskiningeniør ved Carnegie Mellon University i Pittsburgh, introducerede en ny enhed, der tillader visualisering af termiske billeder i fuld opløsning i store farver på stoffer i stort volumen.
I mellemtiden har Jens Karlsson fra Villanova University i Pennsylvania for nylig fanget ultra-slow-motion mikroskopiske videosekvenser fra det øjeblik isen går ind i små lommer mellem to tæt bundne celler og derefter forårsager krystallisering inden i dem.
Perspektiverne på disse metoder kunne bringe nye ideer til, hvordan man manipulerer fryseprocessen, siger Karlsson, der prøver at finde ud af, hvordan man kryopervarer væv gennem omhyggelig kontrol af fryseprocessen og optøningsprocessen, snarere end gennem forglasning.
En mulighed er at genetisk designe celler, der kan overtales til at danne celle-cellekryds, der er i stand til at modstå kryopræservering. Den næste opgave ville være at finde en måde at styre dannelsen af ekstracellulær is på, så den ikke påvirker funktionen af et organ.
Karlsson er også villig til at bruge computersimuleringer af fryseprocessen til effektivt at teste millioner af mulige protokoller.
"Vi har brug for disse typer værktøjer for at fremskynde fremskridt, " siger Karlsson, der sammenligner opgaven med "at forsøge at nå månen med en brøkdel af de midler, der er afsat til denne indsats."
Selv med begrænsede ressourcer har området vist, at isfri kryokonservering er praktisk for små væv, såsom et blodkar-segment. "Barrieren, der er tilbage, og det er vigtigt, " siger Taylor, "er at skalere den til et menneskeligt organ."
For Karlsson, der har mistanke om, at en sådan indsats "muligvis støder ind i en mur", før glasering nogensinde tjener menneskelige organer, udgør frysemetoder (eller hvad han kalder isbaserede metoder) en lige eller endda en sti Mere pålidelige over for succes.
Men der er en sidste opfattelse, der skal tages alvorligt. "Ingen kryokonserveringsteknologi giver 100% overlevelse af komponentceller, " siger Taylor.
"I mange anvendelser kan dette tolereres, men for et enkelt organ kan dette betyde en betydelig grad af skade på reparation efter opbevaring eller transplantation."
I sidste ende betyder det, at uanset hvor godt kryokonserverede prøverne er, er de sandsynligvis af ringere kvalitet sammenlignet med nyligt erhvervede organer.
Kilde:
Tags:
Check-Out Sundhed Ernæring
Hvis du har brug for en ny nyre, et erstatningshjerte eller et andet vigtigt organ, har du ikke mange muligheder. Dette skyldes, at når det kommer til sunde menneskelige organer til transplantationer, der kan redde liv, er der et enormt kløft mellem udbud og efterspørgsel.
I USA blev 26.517 organer transplanteret i 2013, men mere end 120.000 patienter er på ventelisten. Kort sagt, der er ikke nok donationer til alle.
Endnu værre er det, at de organer, der er tilgængelige, spilder nogle gange, fordi de ikke har meget holdbarhed, når den først er fjernet fra donoren.
I øjeblikket er det bedste, vi kan gøre, at holde dem i en speciel løsning lige over 0 grader celsius i en eller to dage, hvilket ikke giver meget tid til at finde patienter, der er fuldt kompatible modtagere til at modtage dem.
Men der er et muligt svar. Hvis forskere kunne finde en måde at fryse organer og bringe dem tilbage uden at pådrage sig skade, kunne vi muligvis opbevare dem i uger eller måneder.
Det samme kunne gøres med de organer, der er designet i laboratoriet, hvis vi er i stand til at skabe dem. Med dette i tankerne planlægger kliket Organ Preservation Alliance, en velgørenhed knyttet til laboratorierne ved Singularity University i NASA Research Park i Californien, at skabe en millionærpris for dem, der tilskynder til fremskridt i denne forbindelse.
Er det muligt at kryopreservere?
Så kunne vi se et tidspunkt, hvor transplantationskirurger åbner frysere og vælger nyrer, lever eller hjerter for at udføre livreddende operationer?
Forskere har kryopervarer eller fryset små grupper af menneskelige celler i 40 år.
De sparer ægløsning og embryoner, der oversvømmer cellerne med opløsninger af de såkaldte kryobeskyttelsesforbindelser, som forhindrer dannelse af iskrystaller, der kan ødelægge cellerne og også beskytte dem mod dødbringende sammentrækning.
Desværre støder de på store forhindringer, når de prøver at implementere denne proces i større skala, da arkitekturen inden for de mest komplekse organer og væv er meget mere sårbar overfor skader relateret til iskrystaller.
En lille gruppe forskere har imidlertid ikke givet op og forbereder sig til udfordringen delvist efter naturens spor.
For eksempel overlever isfisk i Antarktis i meget koldt vand ved -2 grader celsius takket være frostvæskeproteiner (AFP), som reducerer frysepunktet for deres kropsvæsker og binder til Iskrystaller for at stoppe dens spredning.
Forskere har brugt opløsninger, der indeholder antarktiske isfisk-AFP'er til at bevare rottehjerter i en periode på op til 24 timer på nogle få grader under nul.
Imidlertid forekommer modproduktive virkninger ved AFP'erne for dette dyr ved en lavere temperatur: de tvinger dannelsen af iskrystaller til at producere skarpe punkter, der gennemborer cellemembranerne.
En anden frostvæskeforbindelse, der for nylig blev opdaget i en Alaskan-bille, der tåler -60 ° C, kan være mere nyttig.
Men frostvæskeingredienserne alene vil ikke gøre jobbet. Dette skyldes, at frysning også ødelægger celler ved at påvirke strømmen af væsker ind og ud af dem.
Der dannes is i mellemrummet mellem celler, hvilket reducerer væskemængden og øger koncentrationen af opløste salte og andre ioner. Vand løber fra cellerne udad for at kompensere, hvilket får dem til at visne og dø.
I ægløsning og embryoner er kryobeskyttende forbindelser som glycerol meget nyttige: de fortrænger ikke kun vand for at forhindre dannelse af is i cellerne, men hjælper også med at forhindre cellekontraktion og død.
Problemet er, at disse forbindelser ikke kan arbejde med den samme magi i organerne. På den ene side er vævsceller meget mere modtagelige for isindtrængning.
Og selv når cellerne er beskyttet, ødelægger de iskrystaller, der dannes i mellemrummet mellem dem, de ekstracellulære strukturer, der holder organet sammen og letter dets funktion.
vitrifikation
En måde at overvinde farerne ved isdannelse er at forhindre, at det sker. Derfor er nogle forskere forpligtet til en teknik kaldet forglasning, hvor vævene bliver så kolde, at de bliver et isfrit glas.
Metoden er allerede anvendt af nogle fertilitetsklinikker og har produceret nogle af de hidtil mest opmuntrende resultater med hensyn til konservering af komplekse væv.
I 2000 forglasede for eksempel Mike Taylor og hans kolleger ved Cell and Tissue Systems i Charleston, South Carolina, 5 cm lange segmenter af en kanins vene, som er placeret mellem celler og organer med hensyn til kompleksitet og viste, at de bevarer det meste af deres funktion efter opvarmning.
To år senere lavede Greg Fahy og hans kolleger ved det 21. århundrede Medicine, et Californien-baseret cryopreservation forskningsfirma, et gennembrud: De forglasede en kanins nyre og holdt den under glasovergangstemperaturen på - 122 grader celsius i 10 minutter, før de blev afrimet og transplanteret til en kanin, der levede i 48 dage, før den blev slagtet for at undersøge den.
"Det var første gang, at et vitalt organ med efterfølgende livsstøtte var blevet kryopervarer og transplanteret, " siger Fahy. "Det var et bevis på, at det var et realistisk forslag."
Men nyrerne virkede ikke så godt som en sund version, hovedsageligt fordi en bestemt del, medulla, tog længere tid at absorbere kryoprotektantopløsningen, hvilket betød, at der dannedes noget is på den under afrimning.
”Selvom vi var i store humør, vidste vi også, at vi måtte forbedre os, ” tilføjer Fahy.
"Det er det tætteste, vi er kommet, " siger Taylor og tilføjer en advarsel. "Det var mere end 10 år siden, og hvis teknikken var robust nok, skulle der have været rapporter og opfølgningsundersøgelser, der vidner om fundet, noget der ikke har eksisteret."
Fremskridt har til dels været langsom, siger Fahy, fordi det ophørte med at fremstille et kemikalie, der var en nøgledel af hans metode. Imidlertid er hans gruppe genvundet og trådt frem: på det årlige møde i Cryobiology Society i 2013 præsenterede Fahy en metode, der giver ledningen mulighed for at indlæse hurtigere med kryobeskyttelsesmidler.
På trods af Fahys optimisme er det klart, at når det drejer sig om at bevare store organer, udgør forglasning nogle formidable udfordringer. Til at begynde med er der behov for høje koncentrationer af kryobeskyttelsesmidler (mindst fem gange større end ved konventionel langsom afkøling), som kan forgifte celler og væv, de skal beskytte.
Problemet forværres med større væv, fordi der kræves mere tid til at indlæse forbindelserne, hvilket betyder langsommere afkølingstider og flere muligheder for giftig eksponering. Hvis køling derudover er for hurtig eller når for lave temperaturer, kan der muligvis opstå revner.
Denne ekstremt delikate opvarmningsproces giver flere hindringer. Hvis det forglasede præparat ikke opvarmes hurtigt eller forholdsvis ensartet, giver glasigheden plads til krystallisation, en proces, der kaldes devitrifikation, og igen, kan der opstå revner.
(Dette) er en udfordring, som vi endnu ikke har overvundet, "siger John Bischof, kryobiolog og ingeniør ved University of Minnesota." Den begrænsende faktor er den hastighed og ensartethed, som vi kan afrime det. "Og det er fordi Opvarmning udføres normalt udefra og indefra.
Sidste år foreslog Bischof og kandidatstuderende Michael Etheridge en måde at løse problemet på: tilføj magnetiske nanopartikler til kryobeskyttelsesløsningen.
Tanken er, at partiklerne spreder sig gennem vævet og, når de først er begejstrede for magnetfelterne, opvarmer alt hurtigt og jævnt. Duoen arbejder i øjeblikket med Taylor og hans kolleger for at teste metoden i arterier af kaniner.
Is i aktion
For det meste er fremskridt på området sket ved forsøg og fejl: test af kombinationer af løsninger og metoder til frysning og optøning.
Men forskere er også begyndt at drage fordel af nye teknologier for at undersøge nærmere, hvordan is opfører sig i celler og væv.
Hvis processerne forstås detaljeret, kan det forventes, at innovative og mere effektive metoder kan designes til at kontrollere dem.
I de sidste 12 måneder er der sket betydelige fremskridt på dette område. Taylor, der arbejder med Yoed Rabin, en maskiningeniør ved Carnegie Mellon University i Pittsburgh, introducerede en ny enhed, der tillader visualisering af termiske billeder i fuld opløsning i store farver på stoffer i stort volumen.
I mellemtiden har Jens Karlsson fra Villanova University i Pennsylvania for nylig fanget ultra-slow-motion mikroskopiske videosekvenser fra det øjeblik isen går ind i små lommer mellem to tæt bundne celler og derefter forårsager krystallisering inden i dem.
Perspektiverne på disse metoder kunne bringe nye ideer til, hvordan man manipulerer fryseprocessen, siger Karlsson, der prøver at finde ud af, hvordan man kryopervarer væv gennem omhyggelig kontrol af fryseprocessen og optøningsprocessen, snarere end gennem forglasning.
En mulighed er at genetisk designe celler, der kan overtales til at danne celle-cellekryds, der er i stand til at modstå kryopræservering. Den næste opgave ville være at finde en måde at styre dannelsen af ekstracellulær is på, så den ikke påvirker funktionen af et organ.
Karlsson er også villig til at bruge computersimuleringer af fryseprocessen til effektivt at teste millioner af mulige protokoller.
"Vi har brug for disse typer værktøjer for at fremskynde fremskridt, " siger Karlsson, der sammenligner opgaven med "at forsøge at nå månen med en brøkdel af de midler, der er afsat til denne indsats."
Selv med begrænsede ressourcer har området vist, at isfri kryokonservering er praktisk for små væv, såsom et blodkar-segment. "Barrieren, der er tilbage, og det er vigtigt, " siger Taylor, "er at skalere den til et menneskeligt organ."
For Karlsson, der har mistanke om, at en sådan indsats "muligvis støder ind i en mur", før glasering nogensinde tjener menneskelige organer, udgør frysemetoder (eller hvad han kalder isbaserede metoder) en lige eller endda en sti Mere pålidelige over for succes.
Men der er en sidste opfattelse, der skal tages alvorligt. "Ingen kryokonserveringsteknologi giver 100% overlevelse af komponentceller, " siger Taylor.
"I mange anvendelser kan dette tolereres, men for et enkelt organ kan dette betyde en betydelig grad af skade på reparation efter opbevaring eller transplantation."
I sidste ende betyder det, at uanset hvor godt kryokonserverede prøverne er, er de sandsynligvis af ringere kvalitet sammenlignet med nyligt erhvervede organer.
Kilde:








-u-dzieci-i-dorosych--przyczyny-objawy-i-leczenie.jpg)
-zoliwa-przyczyny-i-objawy-choroba-addisona-biermera---leczenie.jpg)